Sådan godkendes aluminium i vacciner
Af Sesilje Bondo Petersen
I 2002 godkendte Lægemiddelstyrelsen og Videnskabsetisk Komite den danske del af Future II, som var et stort verdensomspændende fase 3 forsøg med Gardasil® vaccinen. Det var det sidste forsøg, inden vaccinen blev godkendt af FDA i 2006. I studiet deltog i alt 12.167 sunde og raske piger mellem 16 og 23 år fordelt over 13 lande og 90 forsøgscentre.
En ny artikel i BMJ Evidence-Based Medicine gennemgår forsøgets godkendelse i Danmark og sammenligner studiets dokumenter sendt til hhv. forsøgsdeltagerne, Lægemiddelstyrelsen og Videnskabsetisk Komite. Den kan læses her: ebm.bmj.com/content/ebmed/early/2020/11/08/bmjebm-2020-111419.full.pdf
Forfatterne konkluderer, at der ikke er overensstemmelse mellem informationerne i de gennemgåede dokumenter, og at det ikke er muligt at identificere den korrekte sammensætning af vaccine og placebo. I tabellen herunder ses sammensætning af vaccine og placebo i de respektive gennemgået dokumenter.
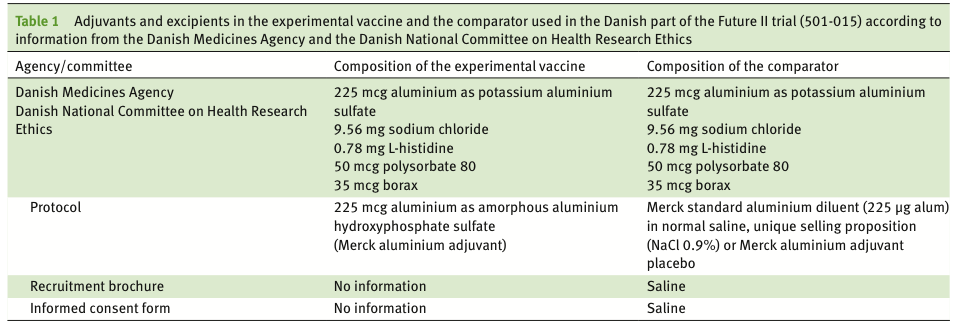
Kilde: ebm.bmj.com/content/early/2020/11/08/bmjebm-2020-111419
Det er værd at bemærke, at Lægemiddelstyrelsen godkendte adjuvansen kaliumaluminiumsulfat og ikke amorf aluminium hydroxyfosfatsulfat (AAHS), som indgår i den godkendte Gardasil® vaccine. Dette skete, selvom der i forsøgsprotokollen stod ét sted, at adjuvansen var Merck standard aluminium opløsning i normalt saltvand men et andet sted, at adjuvansen var Merck aluminium adjuvans. Både i rekrutteringsbrochuren og i det informerede samtykke blev forsøgsdeltagerne fejlagtigt oplyst at placebo var saltvand.
Artiklens forfattere, hvoraf Sesilje Bondo Petersen selv indgik som forsøgsperson, har spurgt ind til godkendelsen af AAHS hos det Europæiske Lægemiddelagentur (EMA). Som det fremgår af artiklens bilag, så blev AAHS først kendt af EMA i 2004 i forbindelse med godkendelsen af vaccinen Procomvax. Merck ville gerne forenkle nomenklaturen for deres godkendte vacciner, og fik derfor EMA til at ændre navnet aluminium hydroxid til AAHS i produktresumeet for Procomvax uden forudgående sikkerhedsvurdering. Dvs. AAHS – en helt nye type aluminiumadjuvans – blot kom ind på markedet via bagdøren uden forudgående sikkerhedsvurdering. EMA oplyser yderligere, at de ikke ligger inde med studier eller anden vurdering af sikkerheden af AAHS. Hvis adjuvansen har været på markedet i en længere årrække uden alvorlige bivirkninger, så vurderer man adjuvansen som værende sikker. EMA sammenligner direkte AAHS med aluminium hydroxid, som traditionelt er brugt i vacciner. EMA vurderer ikke sikkerheden i kombination med adjuvansens hjælpestoffer.
I 2002 da Lægemiddelstyrelsen og Videnskabsetisk Komite skulle godkende Future II, var AAHS altså slet ikke kendt af de Europæiske sundhedsmyndigheder. Man kan derfor spekulere over, om det var derfor Merck fortalte Lægemiddelstyrelsen, at adjuvansen var kaliumaluminiumsulfat og ikke AAHS. Var det en fejl eller var det en helt bevidst handling, så forsøget ville blive godkendt, uden at styrelsen skulle tage stilling til sikkerheden af AAHS? Merck ville næppe få lov til at bruge AAHS som placebo, når stoffet ikke var godkendt eller yderligere sikkerhedsvurderet af myndighederne.
Svaret kan måske findes ved godkendelsen af det efterfølgende Future K forsøg ligeledes med Gardasil®. Future K er det meget omtalte Reisinger forsøg med teenagere. Forsøget blev godkendt af Lægemiddelstyrelsen og Videnskabsetisk Komite i 2003. I alt deltog 1781 børn mellem 9 og 15 år fordelt på 47 forsøgscentre i 10 lande. Som det ses i tabellen herunder, så er det samme billede, som gør sig gældende. Merck fortalte Lægemiddelstyrelsen, at adjuvansen var kaliumaluminiumsulfat og ikke AAHS:

Kilde: ebm.bmj.com/content/early/2020/11/08/bmjebm-2020-111419
Artiklen pointerer en række etiske dilemmaer, da forsøgsdeltagerne i begge danske Gardasil® forsøg fik at vide, at placebo bestod af saltvand. Dvs. deltagerne har ikke vidst, at placebo potentielt var et stof, de kunne blive syge af. Ved basisforsøgets afslutning i 2007 fik deltagerne i Future II tilbud om Gardasil® vaccinen, hvis de var i placebogruppen. Hovedparten af pigerne sagde ja til dette, dog uden at vide, at de så samlet set fik seks doser AAHS over en 5-årig periode. Ingen myndigheder ser ud til at have vurderet sikkerheden af dette.
Artiklen stiller ligeledes en række væsentlige spørgsmål om sikkerheden af Gardasil® vaccinen og sikkerheden af andre aluminiumholdige vacciner generelt. Hvis EMA eller andre sundhedsmyndigheder aldrig har gennemgået sikkerheden af aluminium i vacciner, samt sikkerheden af nyere aluminiumsholdige vacciner (inkl. hjælpestoffer) som AAHS i Gardasil®, så har myndighederne et forklaringsproblem. Vi hører igen og igen fra myndighedernes side, at vacciner er sikre, men hvordan kan de konkludere det, når de ikke ligger inde med sikkerhedsstudier, og når adjuvanserne bruges som placebo i de kliniske studier forud for vaccinernes godkendelse?
Til slut pointerer forfatterne, at der er brug for nye og strengere regulativer, hvad angår sikkerheden af vacciner generelt. De huller, som findes nu, skal lukkes, da producenterne har alt for frie tøjler til at designe de kliniske studier efter forgodtbefindende.
